De Lairessestraat 59 1071 NT Amsterdam 020-679 71 55 omca@me.com www.omca.nl
Botuline (Clostridium botulinum-toxine) (BTX) is een neurotoxisch gif, dat door de bacterie Clostridium botulinum wordt geproduceerd. Andere bacteriën die botuline toxine kunnen produceren zijn C.butyricum, C.baratii en C.argentinense.
Botuline toxine is het meest potente gif dat bekend is, met een LD50 van ongeveer 0,005-0,05 µg/kg. Desondanks wordt het gif ook in de medische wereld en cosmetische industrie toegepast; door de verlammende werking kan het gif spierspasmen tegengaan en de effecten van ouderdom verdoezelen. De bekendste merknaam is Botox, een samentrekking van ‘botuline toxine’, maar er zijn diverse andere producten op de markt.
Historie

Al zo vroeg als de 10e eeuw zijn er bronnen die (een deel van) de symptomen van botulisme beschrijven. Het eerste goed gedocumenteerde onderzoek naar botulisme is dat van de Duitse Justinus Kerner, dat hij tussen 1817 en 1822 uitvoerde.
Hij kwam op het spoor van het gif door het overlijden van verschillende groepen mensen aan voedselvergiftiging na het eten van besmette worst, maar kwam niet verder dan de definitie ‘worst-gif’. Wel begreep hij op basis van zijn experimenten dat het ging om een neurotoxine en vergeleek het effect op zenuwen met dat van roest op een elektrische geleider.
Hij bedacht ook de mogelijke therapeutische toepassing voor het gif. Na de ontdekkingen van Kerner is er bijna tachtig jaar nauwelijks vooruitgang geboekt.

Vanwege het werk van Kerner en Van Ermengem werd aangenomen dat botulisme alleen kon voortvloeien uit het eten van besmet vlees of vis, maar in 1904 werd in Duitsland een botulisme uitbraak veroorzaakt door ingeblikte witte bonen. Bij vergelijking bleken deze bacteriën significant te verschillen en ook toxines bleken verschillende serotypen. Pas in 1919 kregen deze bacteriënstammen de naam A en B, die nu nog steeds gebruikt worden.
Vanaf de jaren ’20 van de 20e eeuw is geprobeerd de toxine te isoleren, en dat is voor type A in 1946 gelukt door 2 afzonderlijke onderzoeksgroepen. In de loop van de jaren 50 en 60 werden ook de serotypen B t/m E opgezuiverd. F en G volgden in de decennia erna. In 1968 deed Alan B. Scott experimenten op primaten om de mogelijkheden van botuline A als geneesmiddel te testen.
In 1989 werd Botuline A door de FDA goedgekeurd voor toepassing in de VS bij strabismus en diverse lokale spierspasmen. In 2000 volgde hun goedkeuring van botuline B voor therapeutische toepassing en in 2002 is gebruik van botuline A voor cosmetische doeleinden toegestaan.
Synthese, structuur en werking
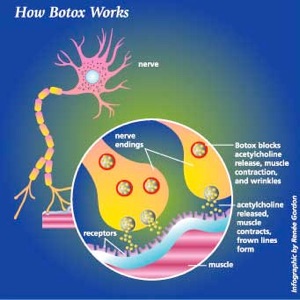
Het toxine bestaat uit twee polypeptideketens, een 'zware keten' van 100 kd (kilodalton) die door een disulfidebinding gekoppeld is aan een lichte keten van 50 kd. De niet-toxische eiwitten bestaan uit hemagluttinerende en niet-hemagluttinerende eiwitten. Botuline wordt in de cel opgenomen bij de pre-synaptische membraan door endocytose, waarna de lichte keten die een enzym is een van de SNARE-eiwitten klieft en dit zo onwerkzaam maakt.Hierdoor wordt exocytose van acetylcholine bevattende vesikels (die de zenuwimpuls overdragen naar de motorische eindplaat van de spier) onmogelijk. Hierdoor kan de spier niet meer worden geactiveerd en ontstaat een slappe verlamming. Voor het uitschakelen van een motorische eindplaat is 1 molecuul botuline genoeg.
Synthese
Botuline neurotixines (BoNT’s) worden geproduceerd door de bacterie Clostridium botulinum als “single chain” eiwitten (het eiwit bestaat uit een enkele keten aminozuren) van ongeveer 150 kiloDalton (KDa).[17] Deze eiwitten kunnen opgedeeld worden in 7 toxinotypes, namelijk BoNT/A t/m BoNT/G, waarvan de types A, B en E toxisch zijn voor mensen.[18] Wanneer de toxines gesynthetiseerd zijn, worden deze geëxporteerd buiten de bacterie. Hier wordt de keten gekliefd in een “light chain” (Lc, ongeveer 50 KDa) en “heavy chain” (Hc, ongeveer 100 KDa). De twee ketens blijven met elkaar verbonden via een disulfidebinding.
Werkingsmechanisme
Het N-terminale uiteinde van de Hc is goed geconserveerd in de zeven verschillende toxinotypes, terwijl het C-terminale einde per toxinotype verschilt.
De heavy chains van BoNT’s binden aan de celmembraan via een receptor. De heavy chains van de verschillende BoNT’s hebben waarschijnlijk verschillende receptoren, maar over de manier van binding en de structuur van deze receptoren is nog niet bekend voor alle toxinotypes.
Van BoNT/A is bekend dat de heavy chain bindt aan sphingomyeline-rijke delen van de membraan waarop fosfoinositides (PIP’s, belangrijke intermediaren voor groeifactor- en vesiculair transport) voorkomen. Uit ander onderzoek is gebleken dat de heavy chain van BoNT/D bindt aan fosfatidylethanolamine (PE), een lipide dat zich bevindt in de membraan.
Het verschil in werking tussen de zeven toxinotypes van BoNT zit in de light chain. De light chain werkt als een zink-afhankelijke endopeptidase en klieft eiwitten van de SNARE families, waar door de Ca2+ gestimuleerde fusie van een synaptisch blaasje (met neurotransmitter) met de presynaptische membraan verstoord wordt. BoNT/B, BoNT/D, BoNT/F en BoNT/G klieven specifiek het “vesicle associated membrane protein” of VAMP in het kort.[20] Dit is een membraaneiwit voor kleine transportblaasjes en het wordt geknipt op verschillende enkelvoudige peptidebindingen. De andere BoNT’s hebben specifieke eiwitten als doelwit. BoNT/A en BoNT/E zijn verantwoordelijk voor het klieven van het synaptosome-associated protein (SNAP-25) en het specifieke doelwit voor BoNT/C is synapsin.
Synapsins zijn eiwitten die verantwoordelijk worden geacht voor het reguleren van de hoeveelheid beschikbare synaptische blaasjes. Het uiteindelijke gevolg van het klieven van deze eiwitten, gerelateerd aan neurotransmitter release, is dat er geen (of beperkte) neurotransmitterafgifte plaatsvindt.
Metabolisme
Er is weinig bekend over de toxicokinetiek van botuline. Wel is duidelijk dat het een hoge affiniteit heeft voor neuronen en dat er geen sprake is van metabole activatie. Dat wil zeggen dat het hele molecuul, zoals het in de bacterie gesynthetiseerd wordt, een toxische werking heeft. Wel is er bekend dat een vergiftiging met botuline toxine in de mens leidt tot activatie van het immuunsysteem en antistofproductie tegen het gif. Bij een mogelijke tweede vergiftiging kan het lichaam sneller reageren, omdat er B-geheugencellen aanwezig zijn.
Preventie en behandeling
Het toxine wordt door koken vrij snel geïnactiveerd. Tegen het toxine bestaan antisera die vrij effectief zijn. Deze schakelt het toxine uit, maar herstelt de neuronen die al zijn aangedaan niet. Het kan nodig zijn de vitale functies (ademhaling) te ondersteunen tot de spierfunctie hersteld is, wat weken kan duren.


Amsterdam Eye Hospital
Oogziekenhuis Amsterdam

